
PRÁCTICA FAMILIAR RURAL│Vol.5│No.1│Marzo 2020
Cómo citar este artículo
Ross, J., Larco, D., Colon, O., Coalson, J., Gaus, D., Taylor, K., Lee, S. Evolución de la Resistencia a los antibióticos en una zona rural de Ecuador. Práctica Familiar Rural. 2020 marzo; 5(1).
NÚMEROS ANTERIORES
ARTÍCULOS ORIGINALES
Evolución de la Resistencia a los antibióticos en una zona rural de Ecuador
Jessica Ross[1], Danny Larco[3,4], Olivia Colon[2], Jenna Coalson[2], David Gaus[3,4], Katherine Taylor[2], Shaun Lee[1,2]
1. Departamento de Biología, Universidad de Notre Dame, Notre Dame, USA
2. Eck Institute of Global Health, Universidad de Notre Dame, Notre Dame, USA
3. Andean Health & Development, UW Department of Family Medicine, Madison, USA
4. Hesburgh Hospital, Santo Domingo, Ecuador
doi: https://doi.org/10.23936/pfr.v5i1.144
Recibido: 08/01/2020 Aprobado: 27/02/2020
Resumen
La resistencia a los antibióticos sigue siendo uno de los más importantes problemas de salud global a la fecha. La resistencia a los antibióticos en América Latina, representa uno de los grandes retos de la medicina actual debido a los diversos mecanismos de resistencia bacteriana y el incremento de los mismos a nivel mundial.
Analizamos las tasas de resistencia a los antibióticos en aislamientos bacterianos de pacientes que asistieron a dos hospitales de la región rural de Ecuador desde el año 2017 hasta el año 2018. Un total de 907 cultivos bacterianos fueron analizados, los cuales se obtuvieron desde el 1 de enero 2017 al 31 de diciembre 2018 y se evaluaron frente a 33 tipos de antibióticos diferentes.
Más de la mitad de los aislamientos donde se identificaron enterobacterias, fueron resistentes a ampicilina (79.8%), ampicilina/sulbactam (57.5%), amoxicilina/ácido clavulánico (62.6%).
El Staphylococcus aureus presentó (55.4%) de resistencia a la oxacilina.
Se concluye que existen altas tasas de resistencia a los antibióticos en zonas rurales del Ecuador, que siguen los patrones mundiales de resistencia ya publicados, y que tanto los médicos como los sistemas de salud deberían tomar en cuenta al crear normativas y políticas para el uso racional de antibióticos.
Palabras clave: resistencia a los antibióticos, BLEE, MRSA, rural, latinoamérica.
Evolution of antibiotic resistance in a rural area of Ecuador
Abstract
Antibiotic resistance (ABR) remains one of the most significant global health concerns to date. ABR in the Americas, specifically, represents one of the highest concerns with regard to types of antibiotic resistance and overall rates. We initiated an analysis of overall rates of ABR from patient collected bacterial isolates in a previously unreported region of rural Ecuador from 2017-2018. 907 total clinical isolates were collected between January 2017 to December 2018 and assessed for resistance to 33 different antibiotic compounds. More than half of the isolates tested were resistant to ampicillin (79.8%), ampicillin/Sulbactam (57.5%), amoxicillin/clavulanic acid (62.6%) on Enterobacteriaceae and oxacillin (55.4%) on Staphylococcus aureus. Across all bacterial isolated from 2017 to 2018, 11 of the 33 antibiotics tested showed a significant increase in resistance. Our analysis identifies evidence of high ABR rates in rural Ecuador, which is likely to be a significant underappreciated contributor to the global persistence of resistant bacterial infections.
Keywords: antibiotic resistance, BLEE, MRSA, rural, latinoamérica.
INTRODUCCIÓN
La Resistencia a los antibióticos es la capacidad de un microorganismo de tolerar concentraciones de antibióticos clínicamente relevantes y volverse en cierta forma tolerante a su acción. Este fenómeno natural se ha ido acelerando bruscamente debido al uso extensivo de antibióticos, administración innecesaria de los mismos, y avances en el campo del desarrollo de nuevos antibióticos.(1,2,3,4) La globalización ha servido para esparcir los genes de resistencia a los antibióticos, el incremento de viajes internacionales y el alto grado de comercio intercontinental ha facilitado la circulación de genes de resistencia generando bacterias con multirresistencia en la mayor parte del mundo. Los países subdesarrollados son los que presentan mayor riesgo para el desarrollo de resistencia bacteriana debido a la falta de regulación y control en la administración, venta y comercialización de antibióticos, ineficientes sistemas de sanitarios y deficientes sistemas de salud (5,6). En Sudamérica los antibióticos son de venta libre, lo que permite su mal uso y abuso en la población general (7,8,9). Se estima que el 78 % de los antibióticos de América latina son vendidos sin receta médica (10). Esto hace particularmente importante el poder monitorizar las tasas de resistencia bacteriana en estas zonas, porque dejó de ser un problema regional y merece atención, estrategias y esfuerzos internacionales.
En la actualidad entendemos que la resistencia bacteriana surge modificaciones enzimáticas en el metabolismo bacteriano que depende de condiciones ambientales y pueden reproducirse a travez de cambios genéticos, las mutaciones genéticas se producen al azar y la probabilidad de aparición aumenta a medida que aumenta la presión ambiental o se transfieren entre bacterias a través de genes extracromosomales (11).
Ecuador, como todo país en Latinoamérica, es muy vulnerable ante el incremento de la resistencia a los antibióticos. Aunque es un país considerado en vías de desarrollo con ingresos económicos a niveles medio-alto. La separación entre los sistemas de salud pública o estatal y privada provoca inconvenientes y problemas para un adecuado acceso a una atención de salud de calidad (12,13). Las áreas rurales representa un tercio de la población nacional, cuentan con servicios de primer nivel sin laboratorios de microbiología lo que imposibilita el diagnóstico acertado de bacterias resistentes (14). Pacientes con infecciones bacterianas tratados en hospitales o centros de salud rurales son una fuente potencial de cultivos bactarianos no reportados o no identificados de patógenos multirresistentes a los antibióticos, particularmente por la falta de información acerca del análisis de patrones de resistencia en estos microrganismos y el manejo de terapia antibiótica empírica.
En Ecuador, el Instituto Nacional de Investigación en Salud Pública (INSPI) es la única entidad que ha monitoreado la resistencia bacteriana hasta el año 2017. En su informe del Centro de Referencia nacional de resistencia a los antimicrobianos reportan porcentajes de resistencia para Escherichia coli en infecciones de vías urinarias de origen comunitario con valores alarmantes. Resistencia a ampicilina entre 70.4 y 87.2 %, ampicilina-sulbactam entre 37.8 y 53.6 %, trimetoprim-sulfametoxazol entre 52.7 y 70.8 %, ciprofloxacina entre 45.5 y 79.1 % y gentamicina entre 18.4 % y 30.2 % (15).
En un estudio anterior publicado el 2018, tomamos muestras de orina de pacientes ambulatorios entre el año 2016 y 2017 en la misma zona geográfica para analizar patrones de resistencia, obtuvimos valores similares a los de este estudio. Del total, 481 aislamientos correspondieron a Escherichia coli (85 %) destacando un 83 % de resistencia a ampicilina, 56 % de resistencia a doxiciclina, 53 % de resistencia a trimetoprim-sulfametoxazol, 37 % de resistencia a ciprofloxacina y 21 % de resistencia a gentamicina (27). Otro estudio similar de 235 aislamientos de heridas infectadas en áreas rurales del Ecuador nos arrojó un total de 92 Staphylococcus aureus de los cuales el 44.7 % eran oxacilino-resistentes (MRSA) (28).
MÉTODO
Población
Para este estudio recolectamos la información de los patrones de resistencia de aislamientos bacterianos de dos hospitales, “Hospital Hesburgh” un hospital de segundo nivel en Santo Domingo de los Colorados y el “Hospital Docente Pedro Vicente Maldonado” ubicado en un área rural noroccidente del Ecuador. Las muestras vienen de varios tipos de fuentes, tanto de infecciones tegumentarias como sistémica y de pacientes ambulatorios como hospitalizados. Las muestras analizadas fueron recogidas y procesadas desde el 1 de enero 2017 hasta el 31 de diciembre 2018. En total fueron analizadas 907 muestras.
Diseño del estudio
Los perfiles de resistencia fueron obtenidos mediante el método de difusión por disco de Kirby-Bauer categorizando cada aislamiento como sensible, intermedio o resistente frente a cada antibiótico específico. Los aislamientos en unos casos fueron resembrados a partir de una sola colonia para poder realizar las pruebas de susceptibilidad de forma adecuada y evitar contaminaciones cruzadas. Cada muestra se procesó siguiendo los procedimientos estandarizados por parte del CLSI (Clinical and Laboratory Standards Institute) y las guías de la SEIMC (Sociedad Española de Microbiología Clínica.) Se usó agar Müller Hinton y discos impregnados de antibióticos a las concentraciones específicas según la técnica. Las cajas fueron incubadas durante al menos 18 horas a 37ºC antes de realizar las lecturas. Un total de 33 antibióticos diferentes fueron probados. Las bacterias fueron identificadas usando kits de identificación mediante pruebas bioquímicas de la Marca Microgen®. Los antibióticos para cada especie bacteriana fueron escogidos en base al género bacteriano a analizar, solo antibióticos que hayan sido aprobados por el CLSI y que tengan actividad bactericida frente a dicha bacteria fueron probados, descartando así la posibilidad de malinterpretar resistencia intrínseca.
Alta resistencia se definió como más del 50 % de resistencia a un particular antibiótico. Resistencia intermedia se categorizó como entre el 20% y 50 % y baja resistencia como menos del 20% de resistencia de una especie bacteriana específica frente a un antibiótico específico. Todos los aislamientos considerados como BLEE fueron identificados fenotípicamente, primero como screening mediante la sinergia entre los discos de amoxicilina-ácido clavulánico 30 ug/mL y ceftriaxona 30 ug/mL. Luego fueron realizados test confirmatorios mediante los lineamientos del CLSI en los que indican la presencia de BLEE si la diferencia de tamaño del disco entre ceftazidima 30 ug/mL y ceftazidima-ácido clavulánico 40 ug/mL y entre cefotaxima 30 ug/mL y cefotaxima-ácido clavulánico 40 ug/mL es mayor a 5 mm entre ellos. En Staphylococcus aureus se investigó la resistencia a oxacilina mediante las guías del CLSI con los discos de oxacilina 1ug/mL y cefoxitin 30 ug/mL.
Estadística
La recolección de datos y el análisis estadístico fueron realizados en Excel. Los porcentajes de resistencia fueron calculados tomando el total de muestras resistentes frente al total de muestras investigadas para cada antibiótico. Se analizaron cambios de índices de resistencia entre el año 2017 y 2018, junto a una comparación de porcentajes de resistencia a antibióticos beta-lactámicos entre bacterias productoras de BLEE y bacterias que no las producen usando un test Z de dos colas. Solo se analizaron muestras superiores a 30 datos, las muestras menores a 30 datos no fueron analizadas.
RESULTADOS
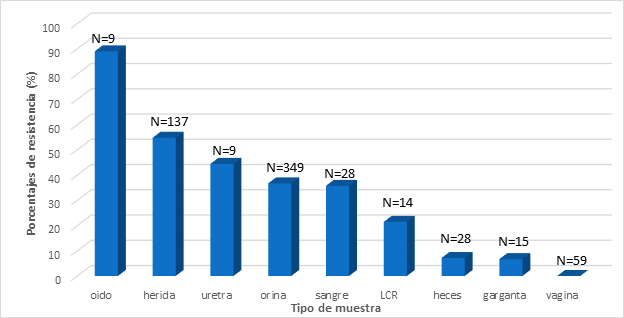
El origen de las muestras analizadas fueron: orina (38.7%) y heridas (15.2%) (Figura 1C). Las bacterias más comúnmente identificadas fueron: Escherichia coli (53.4%), Staphylococcus aureus (18.3%), Klebsiella pneumoniae (5.2%), and Pseudomonas aeruginosa (5.0%) (Figura 1A). Estas cuatro especies presentaron patrones de resistencia a más de un antibiótico. (Figura 1B).
Figura 1A. Distribución total de especies encontradas (N=907)
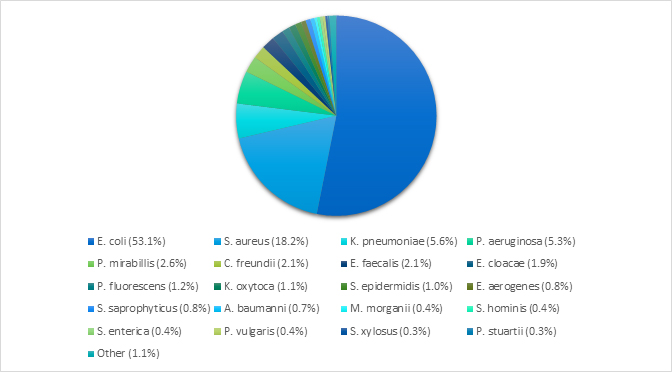
Figura 1B. Porcentajes de resistencia encontrados en los aislamientos bacterianos ponderados (N=819)
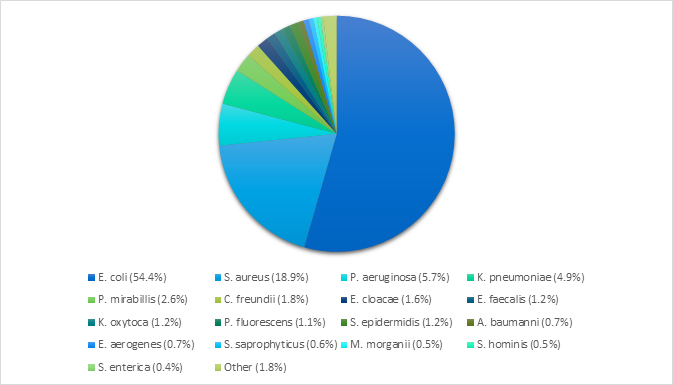
Figura 1C. Porcentajes de resistencia de los aislamientos con número de muestras
Escherichia coli:
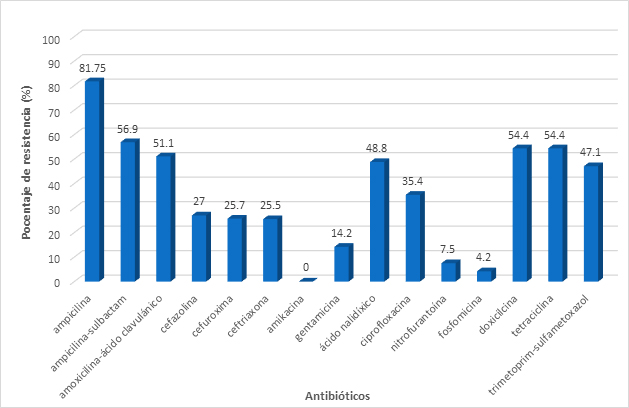
Se obtuvieron 482 aislamientos de Escherichia coli. De éstos, 92.5% mostraron resistencia al menos a un antibiótico. Los más altos índices de resistencia obtenidos fueron a ampicilina (81.3%), ampicilina/sulbactam (53.9%), amoxicilina/ácido clavulánico (51.8%), doxiciclina (55.6%), y tetraciclina (55.6%) (Figura 2A).
Figura 2A. Porcentajes de resistencia por antibiótico en Escherichia coli
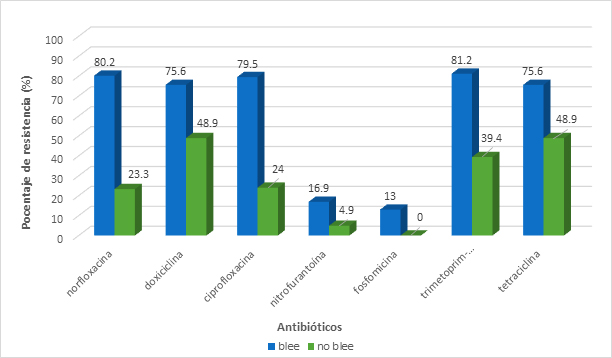
La mayoría de aislamientos de Escherichia coli fueron obtenidos de muestras de orina con el diagnóstico de infección de vías urinarias tanto complicadas como no complicadas (N=311). De éstas 311 muestras el 25.1% de Escherichia coli eran productoras de BLEE, con una resistencia completa a todos los antibióticos beta-lactámicos probados. Escherichia coli productoras de BLEE fueron multirresistentes (resistencia a más de tres diferentes familias de antibióticos) que sus contrapartes no productoras de BLEE (Figura 2B).
Figura 2B. Comparación de porcentajes de resistencia entre E. coli productora y no productora de BLEE en muestras de tracto urinario
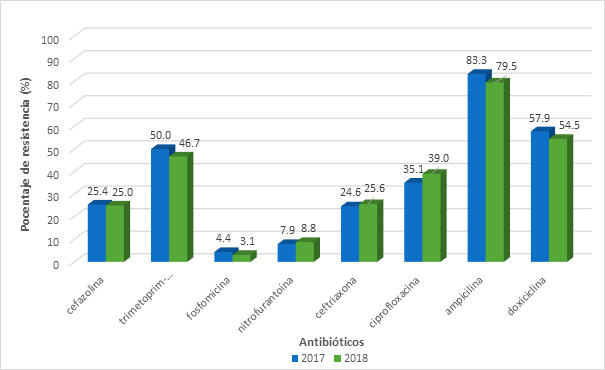
No se encontró diferencias significativas en los porcentajes de resistencia entre los aislamientos de Escherichia coli del año 2017 frente a los del año 2018 ni entre los aislamientos de Escherichia coli urinarios y de otras fuentes (Figura 2C).
Figura 2C. Comparación de porcentajes de resistencia de Escherichia coli urinario entre 2017 y 2018
Staphylococcus aureus:
Es el segundo aislamiento más encontrado (N=165). El 81.1% fueron resistentes al menos a un antibiótico, mientras que 73.3% fueron resistentes a al menos a tres o más familias de antibióticos lo que los califica como multirresistentes. La mayoría de aislamientos fueron obtenidos de infecciones cutáneas (N=86), incluyendo heridas, úlceras, heridas quirúrgicas y abscesos. El estudio nos muestra una alta resistencia a oxacilina calificando las cepas como oxacilino-resistentes (MRSA, por sus siglas en inglés) (54.9%) y mediana resistencia a eritromicina (42.5%), clindamicina (31%), y trimetoprim-sulfametoxazol (26.5%). Todos los Staphylococcus aureus analizados fueron sensibles a vancomicina y linezolid. Encontramos bajos niveles de resistencia a gentamicina (13.5%), ciprofloxacina (11.7%) y tetraciclina (18.6%) (Figure 3A).
Figura 3A. Porcentajes de resistencia en Staphylococcus aureus

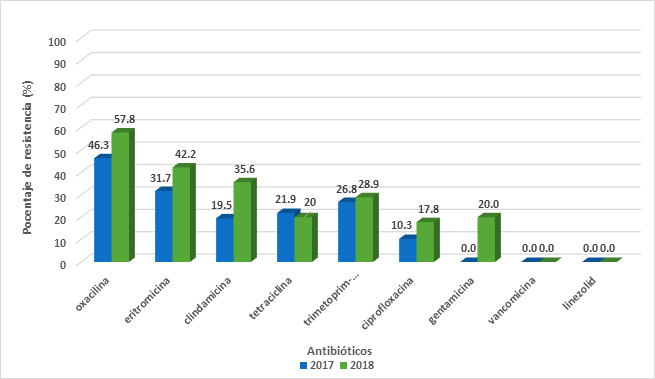
Staphylococcus aureus encontrado en heridas cutáneas presentaron alta resistencia a oxacilina (MRSA) (52.3%), mediana resistencia a eritromicina (37.2%), clindamicina (27.9%), trimetoprim-sulfametoxazol (27.9%), y tetraciclina (20.9%). El análisis comparativo del año 2017 frente al año 2018 mostró un incremento significativo en la resistencia a gentamicina. En 2017, no se observó resistencia a gentamicina 0% (N=41), mientras que en el 2018 se incrementó a un 20.9% (N=43) (Figura 3B).
Figure 3B. Comparación de porcentajes de resistencia de Staphylococcus aureus entre 2017 y 2018
Klebsiella pneumoniae:
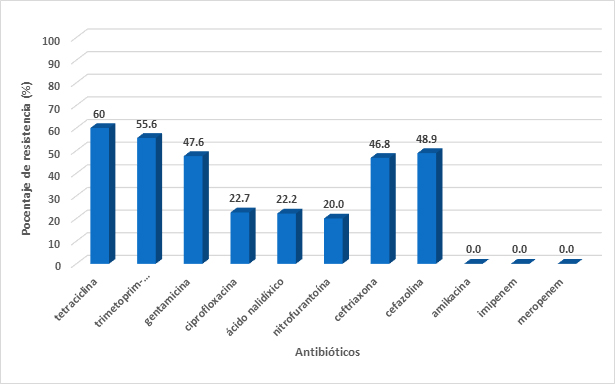
Klebsiella pneumoniae es el aislamiento que ocupa el tercer lugar en orden (N=51), con una resistencia del 78.43% al menos a un antibiótico. Klebsiella pneumoniae fue la segunda causa de infección de vías urinarias con un 4.3% de todos los aislamientos urinarios. Adicionalmente, 43.9% de todas las Klebsiella pneumoniae son productoras de BLEE. No se encontró ningún aislamiento resistente a carbapenémicos. (Figura 4A). Klebsiella pneumoniae también presentó altos niveles de resistencia a tetraciclina (60.0%) y trimetoprim-sulfametoxazol (55.6%). Se obtuvo mediana resistencia ante gentamicina (47.6%), ácido nalidíxico (22.2%), y ciprofloxacina (22.7%). No existió resistencia a carbapenémicos, colistina y amikacina. (Figura 4A).
Figura 4A. Porcentajes de resistencia en Klebsiella pneumoniae
Pseudomonas aeruginosa:
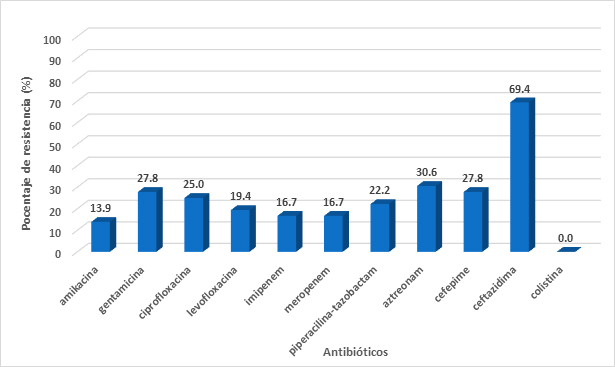
El cuarto aislamiento más común encontrado fue Pseudomonas aeruginosa (N=48). Al menos 97.9% de todos los aislados fueron resistentes al menos a un antibiótico. El origen de los aislamientos fue en su mayoría de aspirados traqueales (25.0%) de pacientes de terapia intensiva. Se observó altos niveles de resistencia ante ceftazidima (66.4%), niveles medios de resistencia ante gentamicina (27.7%), ciprofloxacina (25.0%), aztreonam (30.6%) y cefepime (27.8%). Todos los aislamientos de Pseudomonas aeruginosa fueron sensibles a colistina (Figura 5A). Debido al escaso número de aislamientos de Pseudomonas aeruginosa no se pudo realizar el análisis de resistencia entre los años 2017 y 2018 debido a que la muestra estadística no era significativa.
Figura 5A. Porcentajes de resistencia en Pseudomonas aeruginosa
El análisis de todos los aislamientos obtenidos (N=907), muestra un alto nivel de resistencia en enterobacterias a ampicilina (78.0%), amoxicilina/ácido clavulánico (54.1%), ampicilina/sulbactam (53.0%) y para Staphylococcus aureus a oxacilina (54.9%). No se encontró aislamientos resistentes a vancomicina, linezolid, ni colistina. (Figura 6A).
El 2017 no encontramos resistencia ante amikacina, meropenem e imipenem, pero en el 2018 encontrados 5 aislamientos de Pseudomonas aeruginosa que fueron resistentes a imipenem, meropenem y amikacina lo que incrementó el porcentaje de resistentica un 0.2 %. (Figura 6B). La resistencia bacteriana en general se incrementó en un (33%) del 2017 con los datos obtenidos el 2018 (Figura 6B-E) en algunos casos duplicando o triplicando los porcentajes de resistencia como el cefepime (del 8.1 % al 40.3%), aztreonam (del 3.8 % al 36.0 %), gentamicina (del 10.3 % al 29.0 %), levofloxacina (del 9.0 % al 19.3 %), azitromicina (del 16.7 % al 51.2%) y clindamicina (del 21.5 % al 44.4 %).
Figure 6A. Porcentajes globales de resistencia bacteriana por antibiótico

Figure 6B. Comparación de porcentajes de resistencia para beta-lactámicos entre 2017 y 2018

Figure 6C. Comparación de porcentajes de resistencia para aminoglucósidos entre 2017 y 2018

Figure 6D. Comparación de porcentajes de resistencia para quinolonas entre 2017 y 2018

Figure 6E. Comparación de porcentajes de resistencia para varios tipos de antibióticos entre 2017 y 2018

DISCUSIÓN
El análisis de resistencia a los antibióticos en dos hospitales rurales del Ecuador durante un período de tiempo de dos años identifica similitud con los tipos de hallados en otras partes del mundo. Los gérmenes aislados y analizados en este estudio forman parte de la lista global de amenazas urgentes de la Organización Mundial de la Salud y son de alto interés clínico como epidemiológico. Muchos de los aislamientos analizados presentaron resistencia a uno o dos familias de antibióticos diferentes encontrándose casos de multirresistencia que amerita una vigilancia detallada por parte del sistema de salud.
Escherichia coli fue la causa principal de infección de vías urinarias y presenta altos niveles de resistencia ante antibióticos considerados de primera línea para su tratamiento.22,23 El estudio determinó mediana y alta resistencia para antibióticos prescritos frecuentemente para el tratamiento de infecciones de vías urinarias no complicadas como se muestra en la Figura 2B, excepto nitrofurantoína (7.6%) y fosfomicina (3.6%). Esto sugiere que aun estos dos antibióticos pueden ser una opción viable para el tratamiento de infecciones de vías urinarias complicadas y no complicadas. Las tasas de resistencia se han incrementado considerablemente desde el año 2017 al 2018 en un 33 % lo cual constituye un dato alarmante.
Las tasas de resistencia bacteriana obtenidas en el estudio son similares a las de otros países de América Latina; tomando en cuenta que no hay muchos estudios comparativos recientes citamos dos, a Sader et al. quien publicó que la tasa más alta de producción de BLEE fue encontrada en aislamientos provenientes de América Latina (34,6 %), comparado con Europa (19,7 %) y Norte América (10 %).29 y a Rossi et al. que incluyó 504 aislamientos urinarios de Escherichia coli en nueve hospitales de Lima durante el 2008 y 2009 encontrando una tasa de 26,8% de producción de BLEE y en Klebsiella pneumoniae y Escherichia coli aisladas de hemocultivos la incidencia de BLEE fue de 75,1% y 76,8 %, respectivamente.30
CONCLUSIÓN
Las tasas globales de resistencia al año 2018 llegaron a un 33 % debido especialmente al incremento de aislamientos productoras de beta lactamasas de espectro extendido, en las cuales antibióticos de primera línea para su tratamiento presentan altos niveles de resistencia
El análisis de este estudio muestra evidencia importante de las altas tasas de resistencia a los antibióticos en la zona rural de Ecuador, y subraya la necesidad de aumentar los estudios de vigilancia como el nuestro en otras zonas del Ecuador para evaluar si existe una tendencia como en este estudio se evidenció. Este estudio también resalta la necesidad de disponer de una infraestructura específica para el análisis microbiológico de los especímenes recogidos en zonas geográficas rurales del país que probablemente no disponen de recursos para hacerlo, lo que conlleva a que la resistencia como tal no sea informada ni documentada.
REFERENCIAS BIBLIOGRÁFICAS
1. Davies J and DD. Origins and evolution of antibiotic resistance. Microbiologia. 1996;12(1):9-16. doi:10.1128/mmbr.00016-10
2. WHO. Worldwide country situation analysis : Worldwide country situation analysis : World Heal Organ 20 Ave Appia, 1211 Geneva 27, Switz. 2015;(April):1-50. http://www.who.int/drugresistance/documents/situationanalysis/en/.
3. Fair RJ, Tor Y. Perspectives in Medicinal Chemistry Antibiotics and Bacterial Resistance in the 21st Century. Perspect Medicin Chem. 2014:25-64. doi:10.4137/PMC.S14459.Received
4. Martínez JL, Baquero F. Emergence and spread of antibiotic resistance: Setting a parameter space. Ups J Med Sci. 2014;119(2):68-77. doi:10.3109/03009734.2014.901444
5. Nadimpalli M, Delarocque-Astagneau E, Love DC, et al. Combating Global Antibiotic Resistance: Emerging One Health Concerns in Lower-and Middle-Income Countries. Clin Infect Dis. 2018;66(6):963-969. doi:10.1093/cid/cix879
6. Bonelli R, Meurer B, Picao R, et al. Antimicrobial resistance among Enterobacteriaceae in South America: History, current dissemination status and associated socioeceonomix factors. Drug Resistant updates. 2014; 17(1-2):24-36. doi: 10.1016/j.drup.2014.02.001
7. Santa-Ana-Tellez Y, Mantel-Teeuwisse AK, Dreser A, Leufkens HGM, Wirtz VJ. Impact of Over-the-Counter Restrictions on Antibiotic Consumption in Brazil and Mexico. PLoS One. 2013;8(10):6-11. doi:10.1371/journal.pone.0075550
8. Wirtz VJ, Herrera-Patino JJ, Santa-Ana-Tellez Y, Dreser A, Elseviers M, Vander Stichele RH. Analysing policy interventions to prohibit over-the-counter antibiotic sales in four Latin American countries. Trop Med Int Heal. 2013;18(6):665-673. doi:10.1111/tmi.12096
9. Jacobs TG, Robertson J, van den Ham HA, Iwamoto K, Bak Pedersen H, Mantel-Teeuwisse AK. Assessing the impact of law enforcement to reduce over-the-counter (OTC) sales of antibiotics in low- and middle-income countries; a systematic literature review. BMC Health Serv Res. 2019;19(1):536. doi:10.1186/s12913-019-4359-8
10. Auta A, Hadi MA, Oga E, et al. Global access to antibiotics without prescription in community pharmacies: A systematic review and meta-analysis. J Infect. 2019;78(1):8-18. doi:10.1016/j.jinf.2018.07.001
11. Celi Y, Rubio V, Camacho M. "Perspectiva històrica del origen evolutivo de la reisstencia a los antibióticos". Rev Colomb. Biotecnol. Vol XIX No.2 diciembre 2017; 105-117. doi: 10.15446/rev.colomb.biote.v19n2.69501
12. Sánchez Choez X, Armijos Acurio ML, Jimbo Sotomayor RE. “Appropriateness and adequacy of antibiotic prescription for upper respiratory tract infections in ambulatory health care centers in Ecuador.” BMC Pharmacol Toxicol. 2018;19(1):1-11. doi:10.1186/s40360-018-0237-y
13. Eckhardt M, Santillán D, Faresjö T, Forsberg BC, Falk M. Universal health coverage in rural Ecuador: A cross-sectional study of perceived emergencies. West J Emerg Med. 2018;19(5):889-900. doi:10.5811/westjem.2018.6.38410
14. Central Intelligence Agency. South America :: Ecuador— The World Factbook - Central Intelligence Agency. CIA.gov. 2019. https://www.cia.gov/library/publications/the-world-factbook/geos/pe.html%0Ahttps://www.cia.gov/library/publications/the-world-factbook/geos/br.html.
15. Intituto Nacional de Investigación en Salud Pública INSPI Dr. Leopoldo Izquieta Pérez. Centro de referencia nacional de resistencia a los antimicrobianos. Datos de resistencia bacteriana Ecuador. 2017
16. Centers for Disease Control and Prevention. Biggest Threats and Data | Antibiotic/Antimicrobial Resistance | CDC. Novemb 26, 2018. 2018:1. https://www.cdc.gov/drugresistance/biggest_threats.html.
17. Thakuria B, Lahon K. The beta lactam antibiotics as an empirical therapy in a developing country: An update on their current status and recommendations to counter the resistance against them. J Clin Diagnostic Res. 2013;7(6):1207-1214. doi:10.7860/JCDR/2013/5239.3052
18. Fernandes R, Amador P, Prudêncio C. β-Lactams: Chemical structure, mode of action and mechanisms of resistance. Rev Med Microbiol. 2013;24(1):7-17. doi:10.1097/MRM.0b013e3283587727
19. Paterson DL, Bonomo RA. Clinical Update Extended-Spectrum Beta-Lactamases : a Clinical Update. Clin Microbiol Rev. 2005;18(4):657-686. doi:10.1128/CMR.18.4.657
20. Philippon A, Slama P, Dény P, Labia R. A Structure-Based Classification of Class A beta-Lactamases , a Broadly. Clin Microbiol Rev. 2016;29(1):29-57. doi:10.1128/CMR.00019-15.Address
21. Sheu CC, Chang YT, Lin SY, Chen YH, Hsueh PR. Infections caused by carbapenem-resistant Enterobacteriaceae: An update on therapeutic options. Front Microbiol. 2019;10(JAN). doi:10.3389/fmicb.2019.00080
22. Meletis G. Carbapenem resistance: overview of the problem and future perspectives. Ther Adv Infect Dis. 2016;3(1):15-21. doi:10.1177/2049936115621709
23. Perez F, El Chakhtoura NG, Papp-Wallace KM, Wilson BM, Bonomo RA. Treatment options for infections caused by carbapenem-resistant Enterobacteriaceae. Expert Opin Pharmacother. 2016;17(6):761-781. doi:10.1517/14656566.2016.1145658
24. Lee DS, Lee SJ, Choe HS, Giacobbe DR. Community-Acquired Urinary Tract Infection by Escherichia coli in the Era of Antibiotic Resistance. Biomed Res Int. 2018;2018. doi:10.1155/2018/7656752
25. Chu CM, Lowder JL. Diagnosis and treatment of urinary tract infections across age groups. Am J Obstet Gynecol. 2018;219(1):40-51. doi:10.1016/j.ajog.2017.12.231
26. Bush K, Bradford PA. b -Lactams and b -Lactamase Inhibitors: An Overview. 2016; (Table 1).
27. Larco D, Frecuencia y susceptibilidad microbiana en aislamientos urinarios de bacterias productoras de BLEE en dos hospitales regionales de Ecuador. Práctica Familiar Rural. Junio 2019.
28. Gaus D, Herrera Ramírez D, Larco D. MRSA infected wounds in a community hospital in rural tropical Ecuador. Práctica Familiar Rural. 2018 marzo; 3(1)
29. Sader HS, Jones RN, Andrade-Baiocchi S, Biedenbach DJ; SENTRY ParticipantsGroup (Latin America). Four-year evaluation of frequency of occurrence and antimicrobial susceptibility patterns of bacteria from bloodstream infections in Latin American medical centers. DiagnMicrobiol Infect Dis. 2002; 44:273-80.
30. Rossi F, Baquero F, Hsueh PR, Paterson DL, Bochicchio GV, Snyder TA,Satishchandran V, McCarroll K, DiNubile MJ, Chow JW. In vitro susceptibilities of aerobic and facultatively anaerobic Gram-negative bacilli isolated from patients with intra-abdominal infections worldwide: 2004 results from SMART (Study for Monitoring Antimicrobial Resistance Trends). J Antimicrob Chemother. 2006; 58:205-10.



